114年度高雄醫學大學高等教育深耕計畫
產學合作連結-核心議題四
「2025年醫材產品開發實戰系列課程」
|
活動名稱 |
2025年醫材產品開發實戰系列課程 |
||||||||||||||||||||||||||||||||||||
|
活動日期 |
10/21-11/25 |
||||||||||||||||||||||||||||||||||||
|
活動時間 |
14:00-16:00 |
||||||||||||||||||||||||||||||||||||
|
活動地點 |
線上課程 |
||||||||||||||||||||||||||||||||||||
|
活動參與對象 |
KMU SPARK團隊、本校及外校師生 |
||||||||||||||||||||||||||||||||||||
|
活動參與人數 |
全系列約126人 |
||||||||||||||||||||||||||||||||||||
|
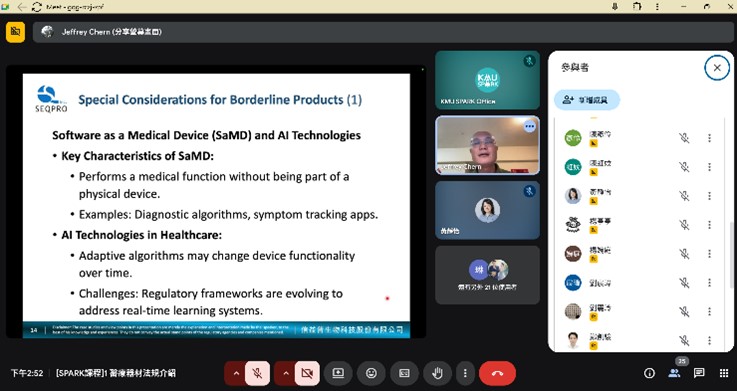
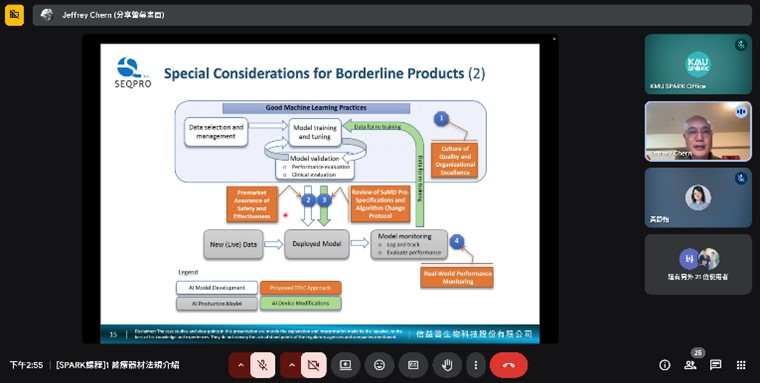
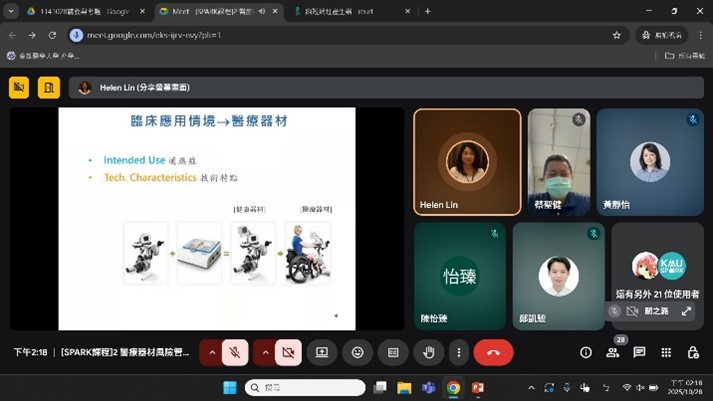
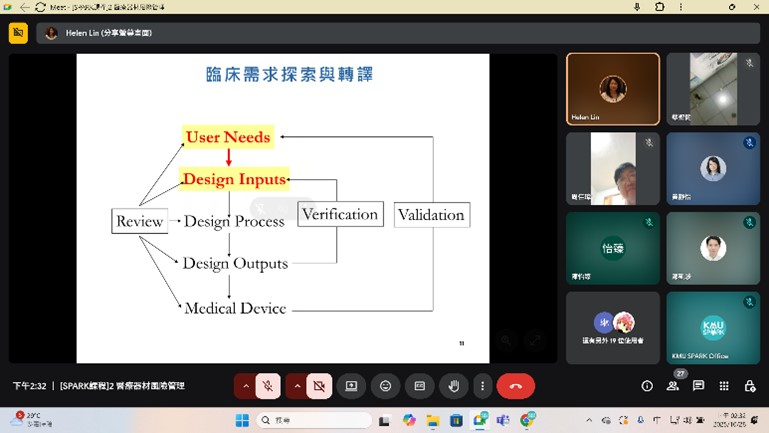
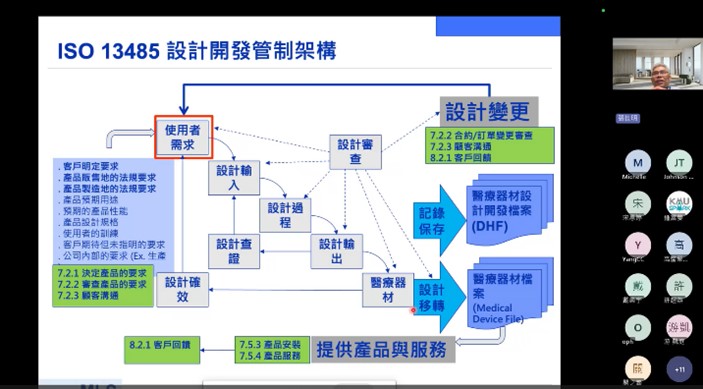
一、 活動重點及目的: 醫療器材產品開發著重於產品規格訂定並符合醫療器材法規規範 完善的開發策略可以決定產品成功與否。KMU SPARK 辦公室安排 了針對醫療器材產品開發實務的課程,邀請到校外專家業師來傳授 相關知識,涵蓋醫材法規標準、風險管理、生物相容性、軟體確效、 IVD 法規食物及品質管理系統等,期望能透過短時間的培訓提供技 術團隊建立醫材產品商品化的實務知識。 課程包含: 醫療器材法規介紹 醫療器材風險管理 療器材軟體生命週期管理與資安要求 良實驗室程序(GLP)對醫材生物相容性測試之重要性 醫療器材品質管理系統 體外診斷醫療器材(IVD)法規簡介及實務案例 二、 活動特色及執行情形:
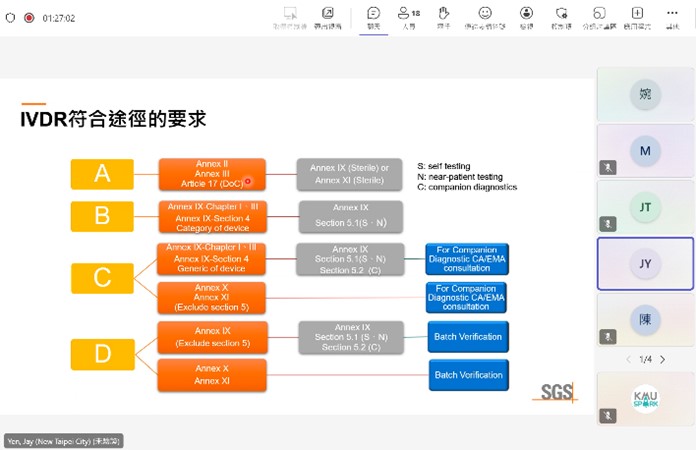
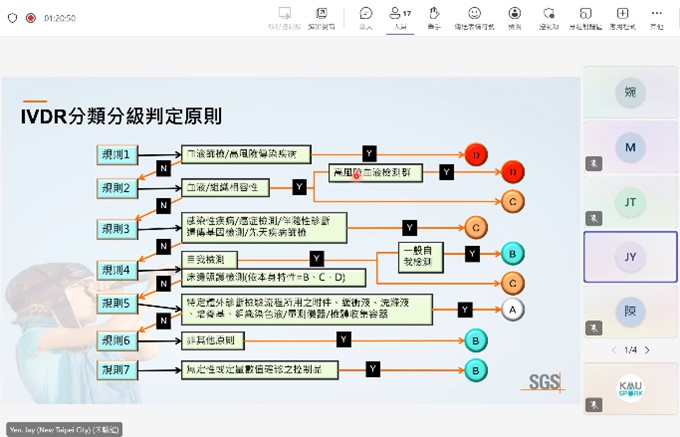
三、 活動之質化指標: -參與者心得與建議: 1. 本次課程對團隊在產品法規與驗證規範的掌握上有很大的幫助。 2. 這門課很適合正在進行產品設計、法規申請或未來打算進入相關產業的人。很建議有興趣的朋友來參加,不只是知識面的補充,更能幫助建立法規思維,提早為進入職場做好準備。 3. 謝謝林博士詳盡得分享醫材風險管理及法規規範,有助於團隊在產品規劃及研發前期就導入風險控管概念,可少走很多冤枉路,真的是獲益良多! 4. 講師分享的醫材軟體及資安規範,剛好符合我們團隊產品類型,有助於我們釐清產品規劃流程及相應的法源,謝謝老師及SPARK辦公室的用心安排! 5. 內容相當實用,講師對醫療器材軟體生命週期與資安管理的說明清楚易懂,讓我更了解實際開發流程中的風險控管與法規重點,對未來專案管理與審查準備皆有很大幫助。 6. 課程內容實用,了解GLP對醫材測試的重要。 7. 感謝講師的分享,除了介紹生物相容性規範和相關查核機制外,重要的是讓我們知道有這樣專業且經認證的公司可委託。 8. 課程內容相當實用,講者將QMS的架構與實務落差講解得很清楚,尤其對ISO 13485與法規要求的解析,讓我更理解醫材產業中品質管理的重要性。課程中舉的案例讓人印象深刻,也學到如何在文件、流程與風險管理間找到平衡,這門課對正準備進入醫材領域或參與品質管理的人非常有幫助。 9. 謝謝講師分享IVD和IVDR規範,獲益良多。
|
|||||||||||||||||||||||||||||||||||||
|
四、 活動花絮: |
|||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||
|
10/21 |
10/21 |
||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||
|
10/28 |
10/28 |
||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||
|
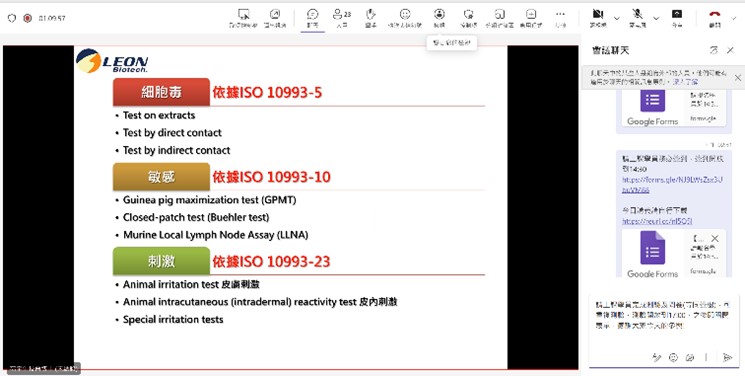
11/04 |
11/04 |
||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||
|
11/13 |
11/13 |
||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||
|
11/18 |
11/18 |
||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||
|
11/25 |
11/25 |
||||||||||||||||||||||||||||||||||||